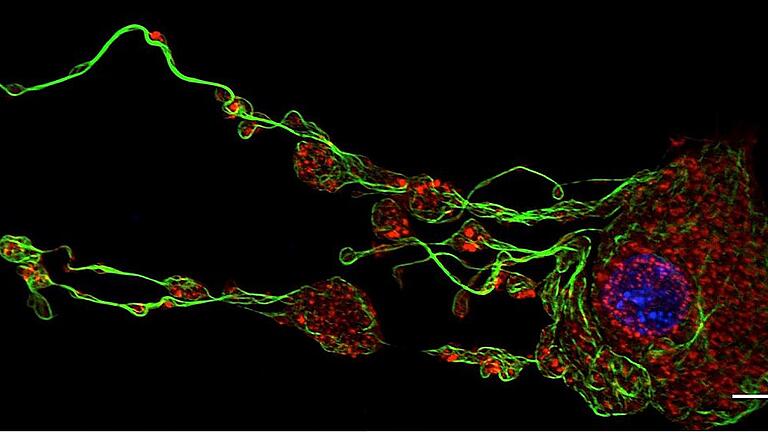
Sie sehen aus wie Scheibchen, haben keinen Zellkern und keine DNA, und sie sind ziemlich klein. Zwei, drei Mikrometer misst ein Blutplättchen, ein Thrombozyt, die roten Blutkörperchen sind drei Mal so groß. Und ganz so viele sind die Plättchen auch nicht: Vier bis fünf Millionen rote Blutkörperchen sind in einem Mikroliter Blut – und „nur“ zwischen 150 000 und 380 000 der winzigen Thrombozyten.
Schnelle Eingreiftruppe im Notfall
Doch so klein sie sind, sie groß ist ihre Bedeutung: Wenn irgendwo im Körper ein Blutgefäß oder eine Blutbahn verletzt wurde, kommen die Thrombozyten, und zwar schnell. Sie lagern sich an das umliegende Gewebe an, werden aktiviert, bilden feine Verästelungen und Tentakel aus, formieren sich in einer Kaskade von sehr schnellen und genau gesteuerten Prozessen zu Klumpen und dichten die offene Stelle ab, damit so wenig Blut wie möglich verloren geht. Schnelle Eingreiftruppe für den Notfall eben. In der Regel wird der Blutpfropfen, ist die Wunde geschlossen und verheilt, weggespült und abgebaut. Wenn nicht, sind die Folgen oft dramatisch: Das Blutgerinnsel kann ein Gefäß komplett verstopfen – und Herzinfarkte, Thrombose und Lungenembolien auslösen.
Als Bernhard Nieswandt vor 30 Jahren in Regensburg mit dem Biologiestudium begann, hätte er vermutlich nicht darauf gewettet, dass die Erforschung der Blutplättchen zu seiner beruflichen Lebensaufgabe würde. Klar war ihm nur: Er wollte etwas Medizinisches machen. Zufällig, natürlich, beschäftigte er sich in seiner Promotion dann mit dem Zusammenhang von Tumoren und Blutplättchen. Und blieb an den Thrombozyten kleben. Oder die Blutplättchen an ihm.
Völlig überraschende Beobachtungen
Drei Jahrzehnte später ist Nieswandt Inhaber des Lehrstuhls für Experimentelle Biomedizin mit Schwerpunkt Gefäßmedizin an der Universität Würzburg und leitet zusammen mit Strukturbiologin Professorin Caroline Kisker das Rudolf-Virchow-Zentrum (RVZ). Und verkürzt gesagt, macht er seit Jahren nichts anderes, als Blutplättchen zu untersuchen – und dann zu versuchen, die völlig überraschenden Beobachtungen zu verstehen. Denn diese kleinen Zellen, die zusammen mit Erythrozyten und Leukozyten im Blut schwimmen, sind, sagt der Biologe so nüchtern wie fasziniert, „ziemlich unterschätzt“.
Blutplättchen sind für die Gerinnung zuständig - aber nicht nur
Was die Forscher in den vergangenen Jahren immer stärker gesehen haben: Dass die kleinen Scheibchen, die sich zusammenklumpen können, bei Weitem nicht nur für die Blutstillung zuständig sind. Sondern, sagt Nieswandt, „für viele, viele andere physiologische Prozesse mitverantwortlich“. Entzündungen, Abwehrmechanismen des Immunsystems, die Entstehung von Tumoren, das Sichern von wichtigen Organfunktionen – bei vielen Prozessen im Körper mischt die schnelle Eingreiftruppe der Blutplättchen, die pausenlos und unbemerkt irgendwo im Körper Löcher verkleben, offenbar mit. Und durchaus auf verschiedene Weise: So erfülle ein Thrombozyt, sagt Nieswandt, je nach Organ durchaus andere Aufgaben – „und macht im Hirn andere Schäden als im Herz“.
Die Entwicklungsgeschichte steckt noch in ihnen . . .
Viel hängt offenbar von der Entwicklungsgeschichte der Blutzellen ab. Denn die Thrombozyten sind „abgewandelte weiße Blutkörperchen“ und waren evolutionsbiologisch mal Zellen, die sowohl Blutungen stillten als auch für die Immunabwehr zuständig waren. „Der Thrombozyt wurde Spezialist, aber er hat viele Funktionen klassischer Immunzellen erhalten“, sagt Nieswandt. Gebildet werden die Blutplättchen – weil sie keine DNA haben und nicht durch Zellteilung entstehen können – im Knochenmark von sogenannten Megakaryozyten. Von diesen riesigen, circa 150 Mikrometer Durchmesser großen Vorläuferzellen werden – „in einem sehr geordneten Prozess“ – Stück für Stück Tausende kleine „Fetzen“ abgetrennt, die dann scheibchenförmig ins Blut gelangen. 100 Milliarden neue Plättchen jeden Tag – die acht bis zwölf Tage jeweils im Blutstrom zirkulieren und in Sekundenschnelle zur Stelle sind, wenn irgendwo die Gefäßwand verletzt wird.
Neue Erkenntnisse - und immer neue Fragen
Als der 49-jährige Forscher vor zehn Jahren am Rudolf-Virchow-Zentrum auf den Lehrstuhl für Experimentelle Biomedizin berufen wurde, meinte er ahnungsvoll: „Wenn ich in Ruhestand gehe, wird man über Blutplättchen immer noch keine fünf Prozent wissen.“ Mit seinem Team hat er die Erkenntnisse in den vergangenen Jahren zumindest schon gemehrt – und vor allem immer neue Fragen aufgeworfen.
Was klar ist: Egal wo im Gefäßsystem etwas passiert, schon rein statistisch gesehen sind die Thrombozyten immer die Ersten, die herbeirauschen. Sie sind innerhalb von Sekunden aktiviert. Und sie locken Immunzellen an geschädigte Stellen: „Die Blutplättchen sind Mediatoren – aber wie genau holen sie die Immunzellen her? Und wieso läuft das im Darm anders ab als in Lunge oder Hirn?“ Die Wissenschaftler beschäftigen sich viel mit den Oberflächenrezeptoren auf den Zellen und den bioaktiven Substanzen, die sie mit sich herumtragen: „Blutplättchen sind kleine Bömbchen“, sagt Nieswandt.
Hoffnung in Sachen Schlaganfall: Neue Medikamente auf dem Weg
Zwei Medikamente, die auf Erkenntnissen der Würzburger Biomediziner beruhen und die in den Laboren am RVZ mitentwickelt wurden, sind gerade in der klinischen Erprobung. Denn schlussendlich geht es bei der Arbeit Nieswandts – neben der grundlegenden Faszination für die scheinbar so simplen, tatsächlich aber komplexen Zellen – um den Nutzen für Patienten, um die Behandlung oder besser noch Vermeidung von Herzinfarkt, Schlaganfall oder akutem Lungenversagen. Blutplättchen zu hemmen, ihre Funktionen zu unterdrücken oder zu aktivieren ist eine diffizile Angelegenheit. Denn der Blutkreislauf ist ein ausgeklügeltes System, der Gerinnungsprozess hochdynamisch. Gewinnen die gerinnungsfördernden Faktoren die Oberhand, verstopfen die Gefäße allzu leicht durch Gerinnsel. Wird die Bildung von Thromben blockiert, zum Beispiel durch die gängigen Medikamente Marcumar oder Aspirin, steigt die Blutungsneigung. „Jeder, der ein Aspirin nimmt, tut nichts anderes, als die Aktivierung seiner Thrombozyten zu hemmen“, sagt Nieswandt. Lässt sich Blut flüssig halten ohne die Gerinnung zu stark zu blockieren?
Wenn der Infarkt überraschend doch fortschreitet
Ein neuer Begriff in der Medizin geht auf die Würzburger Biomediziner schon zurück: „Thrombo-Inflammation“. Denn Nieswandt und sein Team haben in enger Zusammenarbeit mit Professor Guido Stoll von der Neurologischen Klinik gezeigt, wie eng Gerinnungsprozesse und Entzündungen zusammenwirken – und zu welchen dramatischen Organschädigungen das führen kann. Am besten dokumentiert ist dies bislang beim ischämischen Schlaganfall: Die Interaktion von Thrombozyten mit Immunzellen führt zu einer Entzündungsreaktion, der Infarkt schreitet in weiten Arealen des Gehirns noch schneller voran. Das Problem: Auch wenn die Mediziner die verschlossene Arterie im Gehirn wieder öffnen können – seit drei Jahren geht das mechanisch, mit einem „Stentretriever“, einer Art feinstem Maschendraht, der von der Leiste aus durch die Arterie bis zur blockierten Stelle geführt wird – lässt sich der Entzündungsvorgang nicht verhindern. Und auch das Absterben von Nervenzellen nicht.
„Zwei von drei erfolgreich rekanalisierten Patienten profitieren von der Behandlung nach wie vor nicht“, sagt Neurologe Guido Stoll zu der neuen operativen – und schnellen – Behandlungsmethode. „Eine alarmierende Diskrepanz.“ Doch was sind die Ursachen? Der Neurologe berichtet von vielen „weiteren Überraschungen“, die sich nach einem Schlaganfall zeigen. Und bei denen die Blutplättchen offenbar eine entscheidende Rolle spielen. Denn warum ist ihre Funktion nach einem Infarkt im Gehirn so grundlegend anders als in ihrer klassischen Rolle bei der Blutgerinnung? Und wie kommt überraschenderweise auch das Immunsystem ins Spiel?
14 Millionen Euro von der DFG: Antrag auf neuen Sonderforschungsbereich SFB war erfolgreich
„Die Mechanismen sind einfach weitgehend unverstanden“, sagt Nieswandt zu den Beobachtungen, die er und Stoll in den vergangenen Jahren in einem eigenen Forschungsbereich der Universität gemacht haben. Jedenfalls: Die Würzburger Blutplättchen-Erforschung wird sich in den nächsten Jahren ausweiten können: Im Juli geht ein neuer Sonderforschungsbereich (SFB) der Deutschen Forschungsgemeinschaft DFG an den Start, mit einer Fördersumme von fast 14 Millionen Euro: „Thrombozyten – molekulare, zelluläre und systemische Funktionen unter physiologischen und pathologischen Bedingungen“. Nieswandt hat den Antrag gestellt und wird den SFB leiten, beteiligt sind Kardiologen der Universität Tübingen, Forscher der Unimedizin in Greifswald und des Leibniz-Instituts für Analytische Wissenschaften in Dortmund.
14 Millionen Euro – das ist auch in der Biomedizin und gerade für Grundlagenforscher viel Geld. „Aber unsere Stärke ist, dass unsere Arbeit sehr interdisziplinär und kliniknah ausgerichtet ist“, sagt Nieswandt. „Ein Neurologe blickt auf die Thrombozyten anders als ein Kardiologe.“ Der Biologe, der durch Zufall an den Blutplättchen hängenblieb, sagt: „Wir gehen davon aus, dass unser neu gewonnenes Grundlagenwissen schnell zu gänzlich neuartigen Behandlungskonzepten für eine ganze Reihe von Erkrankungen führen kann, die bisher nicht in Zusammenhang mit Thrombozyten gesehen wurden.“ Und wenn Bernhard Nieswandt in Rente geht, wird man über Blutplättchen womöglich mehr als fünf Prozent ihrer Geheimnisse entschlüsselt haben.